马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
本帖最后由 donglei 于 2017-4-7 10:13 编辑 . f+ l/ u/ n! }' }' E
2 q5 P$ n+ ]; v. HClonal Evolutionary Analysis during HER2 Blockade in HER2-Positive Inflammatory Breast Cancer: A Phase II Open-Label Clinical Trial of Afatinib +/- Vinorelbine PLoS Med IF:13.585 4 q% t- N5 ]! p5 }6 d2 ~: E# \
文章概述 t+ V# |, w9 L6 f7 H
1.II期开放式临床试验:HER2阳性炎性乳腺癌患者,阿法替尼单药 vs. 阿法替尼+长春瑞滨,单药治疗前后组织样本前瞻性全外测序;
8 C$ Z8 `: A& A) d# i) V' y2.阿法替尼单药治疗临床获益率35%,阿法替尼+长春瑞滨临床获益率20%,所有患者均存在治疗相关不良反应;
2 ]3 M: n% K' t3 g0 B6 o3.与非炎性乳腺癌相比,炎性乳腺癌基因突变率升高(TP53),新抗原增加;3 ]; M3 ]6 c4 Q' ]8 c2 z! z; ]* l# b
4.治疗前后组织样本基因组变异结构具有一定稳定性,单药治疗前后克隆进化存在两种模式: branched evolution,shifting clonal structure% v; z2 ~: _" S; |
文章亮点
' e1 w8 X4 v E" S5 X0 ?3 S5 x1.着眼于乳腺癌中恶性程度较高、已知信息较少的炎性乳腺癌(IBC)进行研究,一定程度上分析了非炎性乳腺癌(NIBC)与IBC之间的差异;# W- c! }/ t j
2.EGFR、HER2双靶点抑制剂阿法替尼跨适应症应用探索; A+ Y z" o" O+ C* e
3.临床试验+基因组分析,结合临床信息从分子水平解析IBC特征;1 b0 z' t7 m1 p
4.治疗前后节点取样,探究IBC阿法替尼单药治疗前后克隆进化过程
, t( F8 E. G. p R% v" q- L1.研究背景: c3 @* j! l. Y. e2 N
1.IBC是一种发病年龄小、高侵袭性、不良预后、高转移性的乳腺癌亚型,总体发病率约占乳腺癌的1~6%;' B' Y- o% Z. B& s
2.前期报道中,IBC突变频谱与NIBC相比有所不同,但整体景观仍未可知;
& D1 Z& ?1 T: w5 H: J9 O3.一些临床试验中,已有证据表明阿法替尼能使转移性乳腺癌患者获益(BIBW 2992,LUX-Breast 1)。; s$ H+ _9 T, N" A- q; a7 ^
2. 试验设计, V5 p @& Y1 Y6 Q' ?9 ^
研究流程
: [& \! Q3 P5 D2 b' c
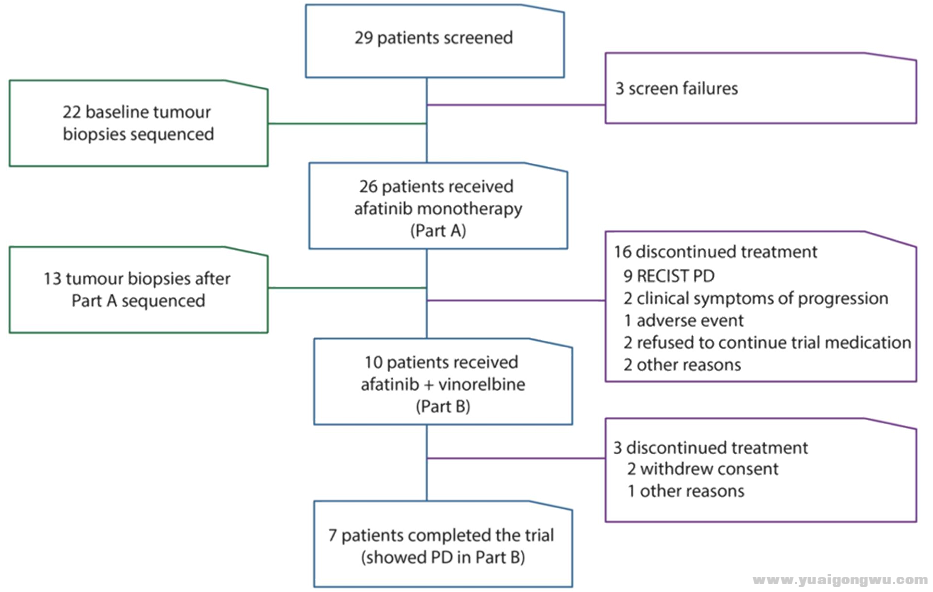 * v9 Y K `6 V3 Y
* v9 Y K `6 V3 Y
1.26名患者接受阿法替尼单药治疗(Part A);疾病进展后,10名患者接受阿法替尼+长春瑞滨联合治疗(Part B)
$ i7 d5 \5 F0 p: X/ K$ U' m2.22名患者拥有治疗前组织样本,13名患者拥有治疗前后匹配组织样本
( j; q6 a' ^ X4 O! [- |7 J/ Q3. 试验结果分析
+ I7 s) N) {, ^. `患者临床获益比较
! n+ d1 A# j, h6 B# v
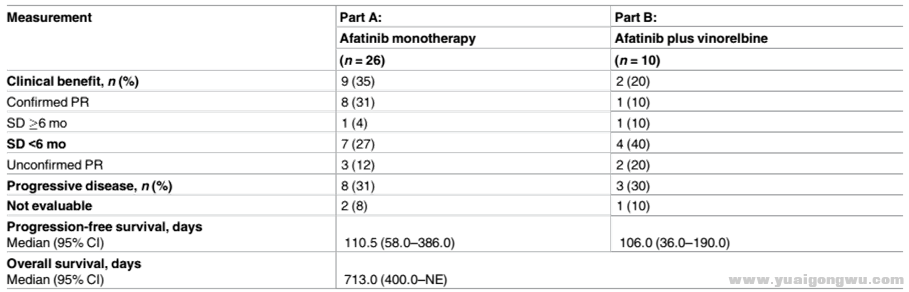 N1 i' q% k7 h2 s$ M4 j
N1 i' q% k7 h2 s$ M4 j
1.单药治疗临床获益率35%,PFS中值110.5 days;26名患者中有7名接受过曲妥珠单抗治疗,在接受与未接受群体中阿法替尼临床获益率分别为0%(0/7)、47%(9/19),PFS中值分别为64 days、151 days# d! R! i9 g8 B" E) O
2.联合治疗临床获益率20%,PFS中值106.0 days;10名患者中有4名接受过曲妥珠单抗治疗,在接受与未接受群体中阿法替尼临床获益率分别为50%(2/4)、0%(0/6)
6 s1 l; z& {, h9 u" e& ^+ Y& f不良反应汇总
7 O9 i2 c( j/ b$ L
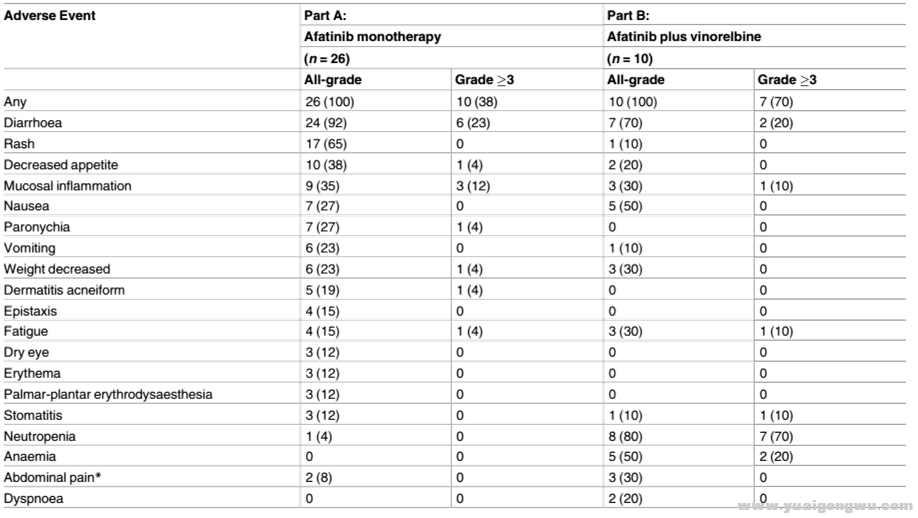 ( e+ o1 f% K' w
( e+ o1 f% K' w
1.无论是单药治疗还是联合治疗,不良反应率均达到100%
- K2 {, w6 @7 j5 r# _% h. L; u3 c2.3级以上不良反应率偏高(38%、70%)
9 R' `$ t% ?6 f: D7 s% b3.单药治疗过程中,最常见不良反应及3级以上均为腹泻;联合治疗过程中,最常见不良反应为中性粒细胞减少及腹泻,最常见3级以上不良反应为中性粒细胞减少+ b& R3 S9 `9 B, ]2 v9 F
4. HER2阳性IBC突变频谱分析& m5 U3 G4 B" }( v ?% V; k
22名患者疗前样本突变频谱分析2 P# ?2 k2 @9 [7 @& k
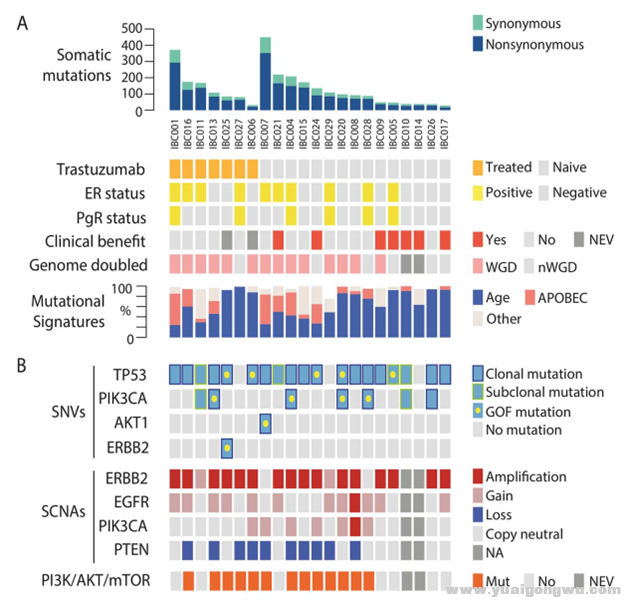
1 [1 g! k3 b z9 d0 I3 q5 _3 X1.平均突变数:134.5(30–468),最常见突变基因为TP53(86.4% ,19/22)3 h w p( t( B
2.PI3K/AKT/mTOR通路相关基因突变率较高
$ l2 v! Z$ |" i; P5 Y3 p3.ERBB2扩增率并非100%,可能由于肿瘤异质性或正常组织污染造成
! x4 z" s4 }- N z3 Y" j" u5 X, |
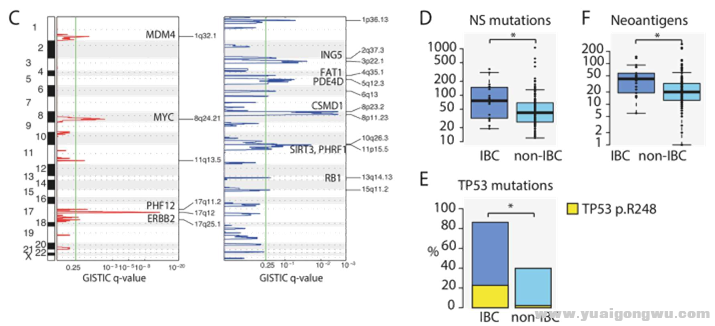
& C( ]! ?$ Q; D7 o6 @2 p1.GISTIC分析确定了HER2阳性IBC患者染色体上4个常见扩增区域,及12个常见缺失区域
" e. M$ s0 @6 \' e v$ L2.与NIBC相比,IBC非同义突变率上升,新抗原增加,TP53突变率上升
5 k3 w, q, V$ [% N& L7 D& L% h4 V' t5. 治疗过程中的克隆进化分析
: {2 u* a( J# [3 r$ f; k! k3 ?% b13对配对组织样本基因组分析9 U8 _- k H; Z0 U$ J; w
 7 @9 J! [* A R+ c
7 @9 J! [* A R+ c
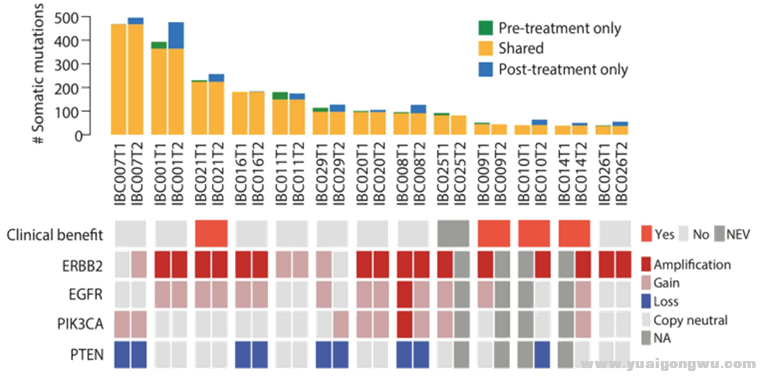
1.疗后13组织样本平均突变数181.4 (50–505),其中79.1% ± 12.0%突变与疗前配对样本共有
0 ^4 s4 g& q, ]2.治疗前后拷贝数变化也具有很强的一致性;分级群聚结果显示,肿瘤组织样本通过患者来源而并非治疗状态聚合
: @" J6 I) r/ U7 a两种克隆进化模式
& @2 @( p7 q- F( g( `$ J W
 3 D) q8 H8 n7 c2 B5 ^' I3 Z
3 D) q8 H8 n7 c2 B5 ^' I3 Z
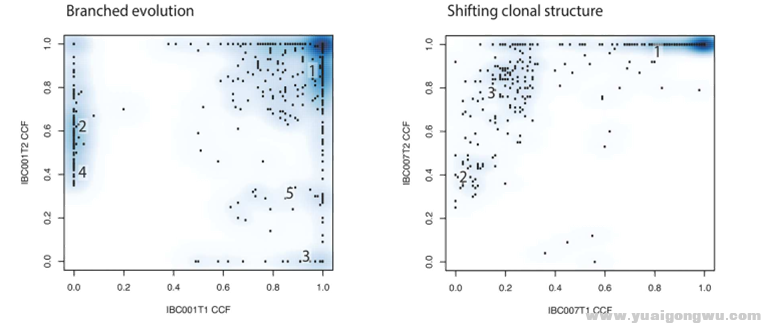
T1:疗前节点样本 T2:疗后节点样本 CCF:cancer cell fraction Clonal cluster::T1、T2 CCF均接近1.0的肿瘤细胞克隆群(图中数字1代表,其余均为Subclonal cluster)
% M0 b0 m$ ?4 G' }* ]1.除主克隆外,亚克隆分别为两节点组织特有
7 F5 Z& A" O. N. S. M2.主克隆、亚克隆均为两节点组织共有,仅CCF在治疗过程中有升高或降低
/ O$ b' V5 |" }; {6. 讨论
7 {0 G* [ l/ l: a: o: ^1.阿法替尼单药或联合长春瑞滨均能使HER2阳性IBC患者获益
. X; J1 u$ e+ N/ W* I- E7 `) t2.HER2阳性IBC具有更高的突变及新抗原负荷,与NIBC相比,TP53突变率偏高是其显著的突变频谱特征- @( R! X/ v2 ~% q* C* n
3.该研究中,治疗前后配对组织基因组分析没有发现突出的耐药性克隆,表观遗传学及微环境可能是IBC耐药性研究的未来方向
6 E. c+ \6 g" x1 u1 c; J8 K转自吉因加科技微信订阅号5 g" o* h6 ~3 X- g% y" [, H
3 v& T+ i* D) h2 K( ~5 {' p) R% p |